目录
快速导航-
研究篇 | 《化学药品药学研究质量管理指南》编制说明
研究篇 | 《化学药品药学研究质量管理指南》编制说明
-
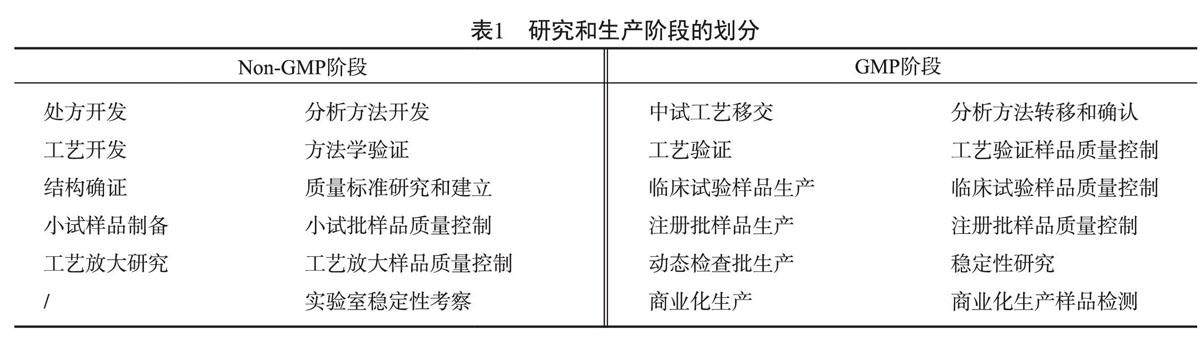
研究篇 | 化学药品药学研究质量管理指南
研究篇 | 化学药品药学研究质量管理指南
-
研究篇 | 《窄治疗指数药物质量评价及标准制订的通用技术要求》编制说明
研究篇 | 《窄治疗指数药物质量评价及标准制订的通用技术要求》编制说明
-

研究篇 | 窄治疗指数药物质量评价及标准制订的通用技术要求
研究篇 | 窄治疗指数药物质量评价及标准制订的通用技术要求
-
研究篇 | 《药物临床试验申办者质量管理体系建设指南》编制说明
研究篇 | 《药物临床试验申办者质量管理体系建设指南》编制说明
-
研究篇 | 药物临床试验申办者质量管理体系建设指南
研究篇 | 药物临床试验申办者质量管理体系建设指南
-
生产篇 | 《人用重组单克隆抗体制品生产通用技术要求》编制说明
生产篇 | 《人用重组单克隆抗体制品生产通用技术要求》编制说明
-
生产篇 | 人用重组单克隆抗体制品生产通用技术要求
生产篇 | 人用重组单克隆抗体制品生产通用技术要求
-
生产篇 | 《中药配方颗粒生产通用规范》编制说明
生产篇 | 《中药配方颗粒生产通用规范》编制说明
-
生产篇 | 中药配方颗粒生产通用规范
生产篇 | 中药配方颗粒生产通用规范
-
生产篇 | 《生物工艺中一次性使用系统生产技术规范》编制说明
生产篇 | 《生物工艺中一次性使用系统生产技术规范》编制说明
-

生产篇 | 生物工艺中一次性使用系统生产技术规范
生产篇 | 生物工艺中一次性使用系统生产技术规范
-
生产篇 | 《药品生产数字化质量保证技术要求》编制说明
生产篇 | 《药品生产数字化质量保证技术要求》编制说明
-
生产篇 | 药品生产数字化质量保证技术要求
生产篇 | 药品生产数字化质量保证技术要求
-
生产篇 | 《免疫细胞治疗产品生产用质粒生产质量管理指南》编制说明
生产篇 | 《免疫细胞治疗产品生产用质粒生产质量管理指南》编制说明
-

生产篇 | 免疫细胞治疗产品生产用质粒生产质量管理指南
生产篇 | 免疫细胞治疗产品生产用质粒生产质量管理指南
-
流通篇 | 《自体CAR-T细胞药品供应链管理规范》编制说明
流通篇 | 《自体CAR-T细胞药品供应链管理规范》编制说明
-
流通篇 | 自体CAR-T细胞药品供应链管理规范
流通篇 | 自体CAR-T细胞药品供应链管理规范
-
流通篇 | 《药品多仓协同运营管理规范》编制说明
流通篇 | 《药品多仓协同运营管理规范》编制说明
-
流通篇 | 药品多仓协同运营管理规范
流通篇 | 药品多仓协同运营管理规范
-
流通篇 | 《临床试验用药品供应链管理规范》编制说明
流通篇 | 《临床试验用药品供应链管理规范》编制说明
-
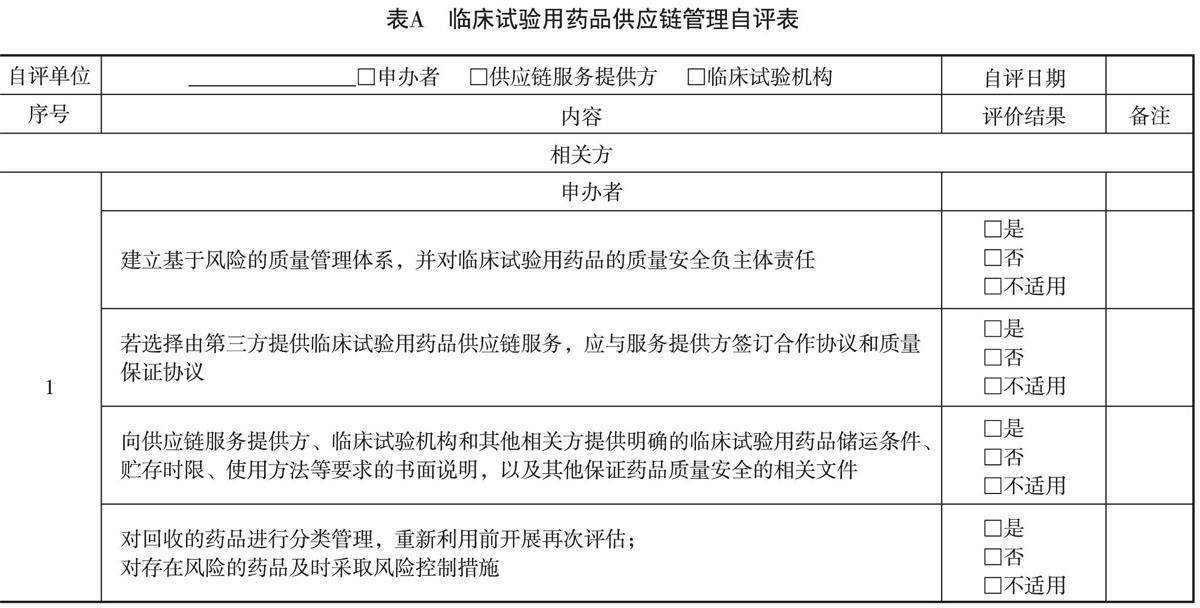
流通篇 | 临床试验用药品供应链管理规范
流通篇 | 临床试验用药品供应链管理规范
-
流通篇 | 《药品上市许可持有人委托销售管理规范》编制说明
流通篇 | 《药品上市许可持有人委托销售管理规范》编制说明
-
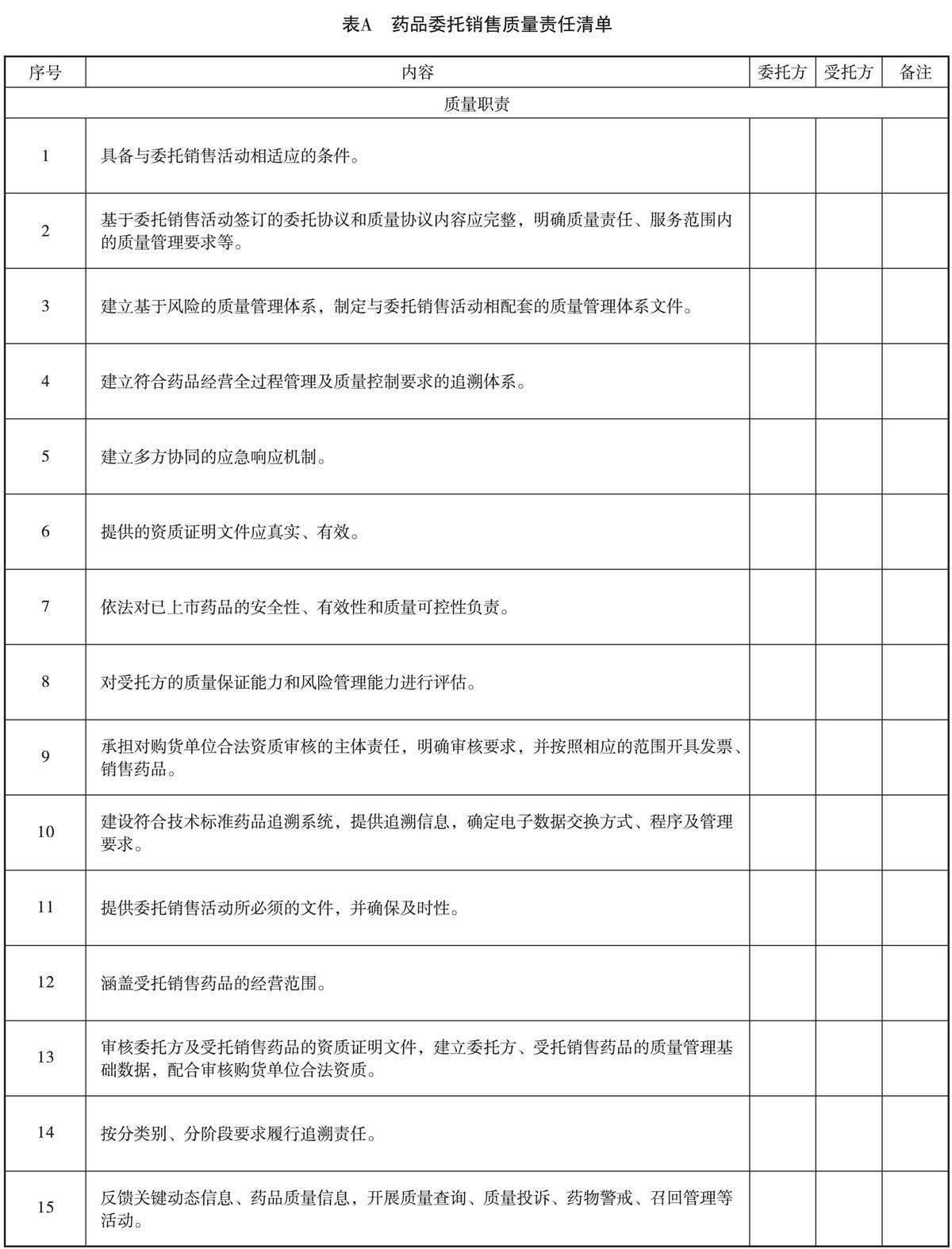
流通篇 | 药品上市许可持有人委托销售管理规范
流通篇 | 药品上市许可持有人委托销售管理规范
-
流通篇 | 《药品DTP模式服务质量体系建设导则》编制说明
流通篇 | 《药品DTP模式服务质量体系建设导则》编制说明
-

流通篇 | 药品DTP模式服务质量体系建设导则
流通篇 | 药品DTP模式服务质量体系建设导则
-
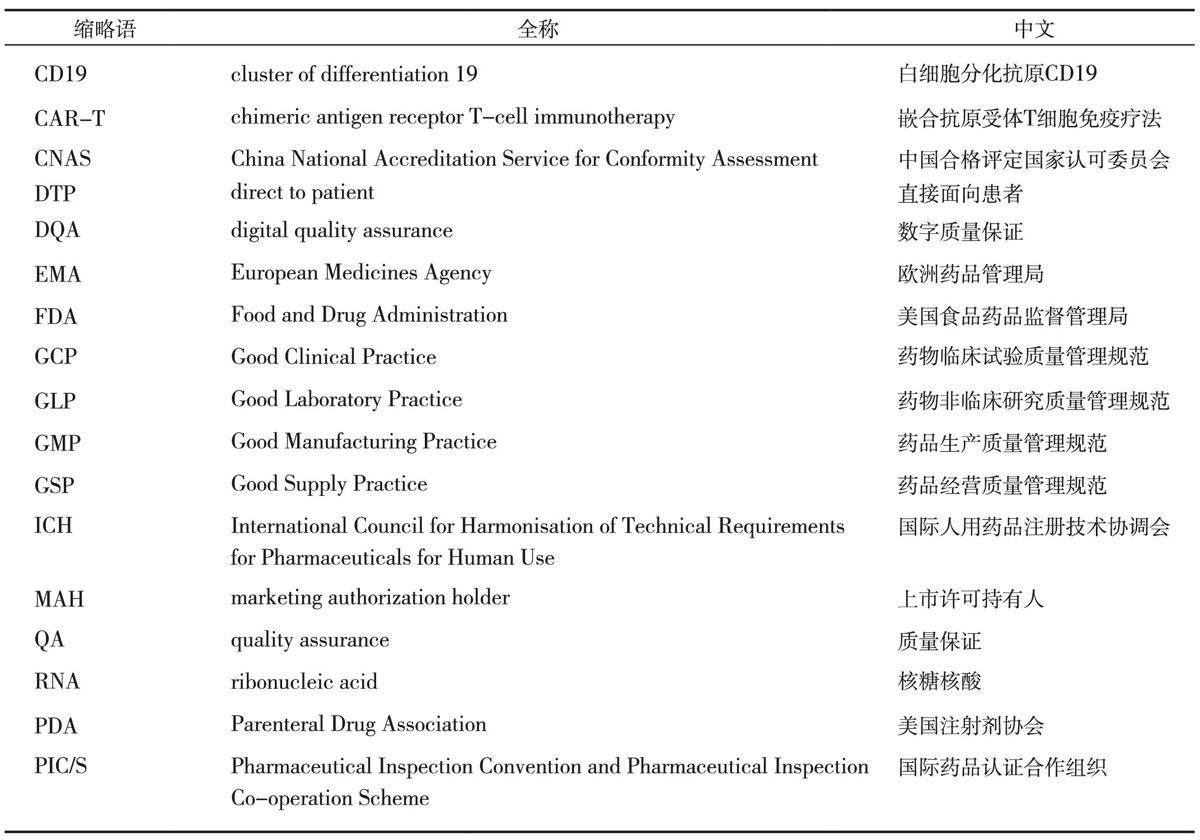
流通篇 | 缩略语中英文全称对照表
流通篇 | 缩略语中英文全称对照表






























 登录
登录